药品审评中心:中国药品审评中心,加速创新药上市的监管变革
近年来,随着中国医药创新的快速发展,药品审评中心(Center for Drug Evaluation,CDE)作为国家药品监督管理局(NMPA)的核心机构,其职能和影响力日益凸显,CDE不仅承担着药品的技术审评工作,还在推动药品审评审批制度改革、优化审评流程、提升审评效率等方面发挥了关键作用。
药品审评中心的职能与定位
药品审评中心是负责药品注册申请的技术审评机构,主要职责包括对新药、仿制药、进口药品等进行技术评估,确保其安全性、有效性和质量可控性,CDE的成立标志着中国药品审评体系从过去的分散化、非专业化向集中化、专业化转变,是中国药品监管体系现代化的重要一步。
加速审评流程,推动创新药发展
过去,由于审评流程冗长,许多创新药在中国上市的时间被大幅推迟,为应对这一问题,CDE推出了一系列改革措施,如优先审评审批程序、附条件批准机制等,旨在加快临床急需且具有明显临床优势的创新药上市进程。
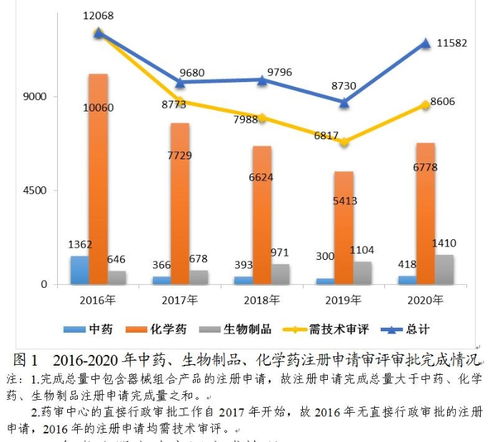
2020年以来,CDE对部分治疗肿瘤、罕见病、儿童用药等领域的创新药实施了优先审评,审评时间从原来的数年缩短至数月,这种高效的审评机制不仅缩短了患者等待新药的时间,也增强了中国医药企业的国际竞争力。
加强与创新企业的沟通与合作
为更好地适应创新药研发的特点,CDE还加强了与创新药企业的沟通机制,通过设立审评咨询会、召开专家研讨会等方式,CDE与企业就药品研发过程中的技术问题进行及时沟通,减少审评过程中的不确定性,提高研发效率。
CDE还积极推动药品审评标准与国际接轨,参与国际人用药品注册技术协调会(ICH)的相关活动,推动中国药品审评体系与国际主流标准保持一致,为中国医药企业“走出去”提供了制度保障。
审评透明度提升与公众信任建设
药品审评的透明度一直是公众关注的焦点,CDE通过公开审评流程、发布审评指南、公示审评意见等方式,提高了审评工作的透明度,CDE还加强了对审评专家的培训,确保审评工作的科学性和公正性,从而增强了公众对药品安全的信心。
随着中国医药创新的持续推进,药品审评中心将继续在药品监管体系中发挥核心作用,CDE将进一步优化审评流程,提升审评能力,推动更多高质量的创新药在中国上市,满足人民群众的健康需求。
药品审评中心作为中国药品监管体系的重要组成部分,不仅在保障公众用药安全方面发挥了重要作用,还在推动中国医药创新、提升国际竞争力方面做出了积极贡献,随着改革的不断深化,CDE将继续引领中国药品审评审批制度的现代化进程。
文章已关闭评论!